Un enlace es la unión entre los átomos de un compuesto. Esta unión se origina en la estructura electrónica de los mismos. La actividad química de los elementos radica en su tendencia a adquirir, mediante su unión con otros átomos, la configuración de gas noble (ocho electrones en la capa más externa, salvo el helio, que sólo tiene dos), que es muy estable.
Aunque los enlaces tienen propiedades bien definidas, la clasificación no es rigurosa, existiendo una transición gradual de uno a otro, lo que permite considerar tipos de enlace intermedios. Por ejemplo la sal común está formada por un no metal, el cloro, y un metal alcalino, el sodio.
En estado puro, ambos son extremadamente peligrosos para el hombre; sin embargo, juntos forman una sustancia, que es inocua en pequeñas cantidades. Se dice, por tanto, que han formado un compuesto químico, una sustancia muy diferente de los elementos que la componen. Muchas de las sustancias que conocemos están formadas por uniones de distintos elementos.
Tipos de enlace químico
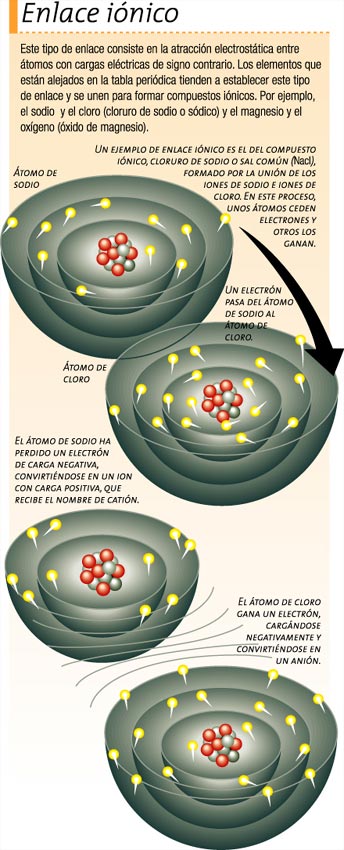
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos electropositivos (elementos con carga positiva) con los de elementos electronegativos (elementos con carga negativa).
De esta manera, el enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo) y en este es necesario que uno de los elementos pueda ganar electrones y el otro perderlo.
Un ejemplo de sustancia con enlace iónico es el cloruro de sodio, en cuya formación se da la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización (es decir, la formación de elementos con carga eléctrica denominados iones) son muy importantes, ya que los dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad.
Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro de sodio, es una red cúbica en la que en los vértices del paralelepípedo (similar a una caja) fundamental alternan iones Cl- y Na+. De esta forma, cada ion Cl- queda rodeado de seis iones Na+, y recíprocamente.
Se llama índice de coordinación al número de iones de signo contrario que rodea a uno determinado en una red cristalina. En el caso del cloruro de sodio, el índice de coordinación es seis para ambos.
En el enlace covalente no existe atracción electrostática, como en el caso anterior. Aquí la situación es totalmente diferente, pues en este caso dos átomos se unen más íntimamente; es decir, ambos comparten algo en común. Y lo común entre estos átomos es un electrón ubicado en la capa más externa.
Así, uno de los átomos se acerca al otro ofreciéndole el electrón de su capa más externa, y el otro átomo, al estar en esta circunstancia, también se acerca y ofrece el electrón más externo de su capa electrónica. Así se encuentran ambos átomos y tanto el electrón de uno como del otro interactúan entre sí, y se da una unión muy fuerte.
El enlace metálico se realiza entre elementos metálicos. Así, los elementos metálicos sin combinar forman redes cristalinas (similares a una red de pescar) con elevado índice de coordinación (es decir, agrupación de átomos de manera ordenada).
En el enlace metálico, los átomos se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
La electrovalencia y la covalencia
La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
La covalencia, número de enlaces covalentes que puede formar un átomo, es el número de electrones desapareados que tiene dicho átomo. Hay que tener presente que un átomo puede desaparear sus electrones al máximo, siempre que para ello no haya de pasar ningún electrón a un nivel energético superior.
¿Sabías que?
En las células de nuestro cuerpo, para formar y romper un enlace químico se requiere la participación de unas moléculas llamadas enzimas.




 Muere Evita
Muere Evita