Los elementos químicos de la tabla periódica se dividen entre metales y no metales. Los metales son cuerpos simples o elementos que, por lo general, poseen un brillo característico y son buenos conductores de calor o electricidad. Y, por el contrario, los no metales se distinguen por no ser buenos conductores de electricidad ni calor y ser frágiles a la manipulación.
¿Quieres conocer otra diferencia? Los metales son elementos químicos extraídos de la tierra o producidos por aleaciones. En tanto, los no metales forman la mayor parte de la tierra y es posible encontrarlos en sus tres estados: sólido, líquido o gaseoso.
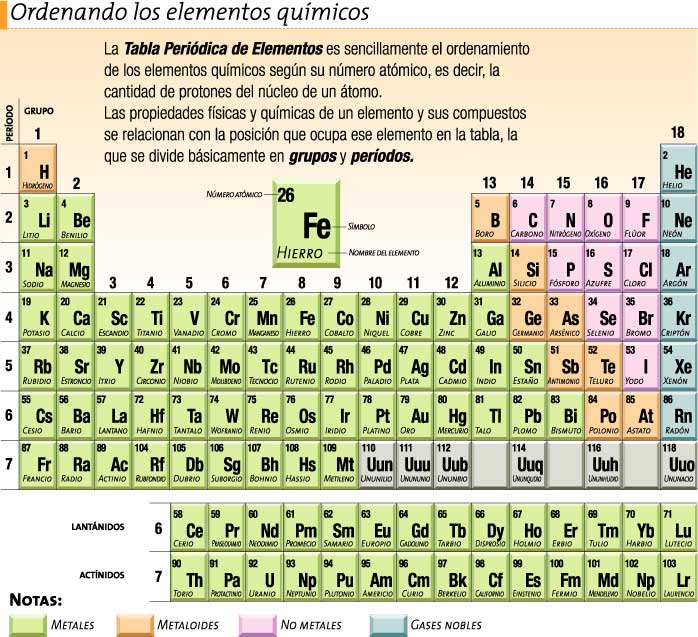
Dentro de la tabla periódica, es posible separar estos grupos de elementos trazando una simple línea diagonal: A la izquierda se encuentran los 84 metales (color verde de la imagen) y, a la derecha, se ubican los 10 no metales, identificados en color rosado(Ver imagen).
Los elementos que integran esta diagonal corresponden al boro, silicio, germanio, arsénico, antimonio, teluro, polonio y astato, los cuales tienen propiedades tanto metálicas como no metálicas.
Tabla periódica
La tabla periódica actual posee 118 elementos. De ellos 94 surgen de manera natural de la Tierra.
Otro dato de la tabla periódica es que 18 columnas verticales. Cada una de ellas conforman grupos de elementos que tienden a tener propiedades químicas similares.
Si ves a la izquierda de la tabla periódica, encontrarás el grupo de los metales alcalinos (litio, sodio, potasio, entre otros). Estos metales se encuentran en estado sólido a temperatura ambiente y que poseen puntos de fusión bajos y que, además, en contacto con el aire se ennegrecerse.
Video: Ejemplos de metales y no metales
Si quieres aprender cuáles son los principales ejemplos de estos elementos químicos, revisa este breve video que preparamos para ti.
¿Cuáles son las diferencias entre metales y no metales?
Conoce cuáles son las 7 principales diferencias entre los elementos metálicos y no metálicos.
| Metales | No metales |
|---|---|
| Presente en estado sólido | Presentes en estado sólido, líquido y gaseoso |
| Buen conductor de electricidad y calor | Mal conductor de electricidad y calor |
| Poseen un alto punto de fusión y ebullición | Poseen una bajo punto de fusión y ebullición |
| Maleables y dúctiles (pueden ser golpeados y estirados) | Frágiles y con baja densidad |
| Ionizan con carga positiva | Ionizan con carga negativa |
| Poseen brillo | No poseen brillo metálico |
| Formados por átomos con uno o tres electrones | Formados por moléculas de dos o más átomos, con entre 4 y 7 electrones |
Elementos metálicos
Estos elementos están formados por átomos, los cuales tienen entre uno y tres electrones que pueden participar de un enlace químico. Cuando se ionizan adquieren una carga positiva.
Su estado físico es sólido (a excepción del mercurio). Poseen un brillo en su superficie y son dúctiles y maleables, es decir, se pueden transformar en alambres o láminas.
Entre sus características se encuentra que son conductores de calor y electricidad. Se pueden hacer aleaciones, fundir o mezclar dos o más elementos.

Los metales son un grupo de elementos químicos que presentan todas o gran parte de las siguientes propiedades físicas: estado sólido a temperatura normal, excepto el mercurio que es líquido; opacidad, excepto en capas muy finas; buenos conductores eléctricos y térmicos; brillantes, una vez pulidos, y estructura cristalina en estado sólido.
Principales ejemplos
Los elementos metálicos más comunes son los siguientes:
- Aluminio
- Bario
- Berilio
- Bismuto
- Cadmio
- Calcio
- Cerio
- Cromo
- Cobalto
- Cobre
- Estaño
- Oro
- Iridio
- Hierro
- Plomo
- Litio
- Magnesio
- Manganeso
- Mercurio
- Molibdeno
- Níquel
- Osmio
- Paladio
- Platino
- Potasio
- Radio
- Rodio
- Plata
- Sodio
- Tantalio
- Talio
- Torio
- Titanio
- Volframio
- Uranio
- Vanadio
- Cinc
Los elementos metálicos se pueden combinar unos con otros y también con otros elementos formando compuestos, disoluciones y mezclas. Una mezcla de dos o más de estos elementos químicos, o de un metal y ciertos no metales como el carbono, se denomina aleación.
Asimismo, las aleaciones de mercurio con otros elementos metálicos son conocidas como amalgamas.
Los metales muestran un amplio margen en sus propiedades físicas. La mayoría de ellos son de color grisáceo, pero algunos presentan colores distintos; el bismuto es rosáceo, el cobre rojizo y el oro amarillo.
En otros de estos elementos aparece más de un color, y este fenómeno se denomina pleocroismo.
El punto de fusión de éstos varía entre los -39 °C del mercurio, a los 3.410 °C del tungsteno. El iridio, con una densidad relativa de 22,4, es el más denso de ellos.

Por el contrario, el litio es el menos denso y un metal blando, con una densidad relativa de 0,53. La mayoría de estos elementos cristalizan en el sistema cúbico, aunque algunos lo hacen en el hexagonal y en el tetragonal.
La más baja conductividad eléctrica la tiene el bismuto, y la más alta a temperatura ordinaria la plata.
La conductividad en elementos metálicos puede reducirse mediante aleaciones. Todos estos elementos se expanden con el calor y se contraen al enfriarse. Ciertas aleaciones, como las de platino e iridio, tienen un coeficiente de dilatación extremadamente bajo.
Ejemplos de elementos metálicos
- Cobre
- Oro
- Plata
- Aluminio
- Bario
- Berilio
- Bismuto
- Cadmio
- Calcio
- Cromo
Elementos no metálicos
Los elementos no metálicos están formados por moléculas de dos o más átomos, los cuales tienen entre 4 y 7 electrones en su última capa. A diferencia de los del tipo metálicos, cuando se ionizan adquieren carga eléctrica negativa.
Es posible encontrarlos en tres estados: sólidos (azufre y carbón), líquidos (bromo) y gaseoso (oxígeno e hidrógeno).
Estos elementos no poseen brillo metálico (solo el yodo). No son buenos conductores de calor ni electricidad (solo el grafito). Su densidad es baja.

Los elementos no metálicos, además, comprenden una de las tres categorías de elementos químicos siguiendo una clasificación de acuerdo con las propiedades de enlace e ionización.
Se caracterizan por presentar una alta electronegatividad, por lo que es más fácil que ganen electrones a que los pierdan.
Los no metales, excepto el hidrógeno, están situados en la tabla periódica de los elementos en el bloque p.
De este bloque, excepto los metaloides y, generalmente, gases nobles, se considera que todos son elementos no metálicos.

El hidrógeno normalmente se sitúa encima de los metales alcalinos, pero normalmente se comporta como un no metal. Un no metal suele ser aislante o semiconductor de la electricidad.
Los no metales suelen formar enlaces iónicos con los elementos metálicos, ganando electrones, o enlaces covalentes con otros elementos no metálicos, compartiendo electrones. Sus óxidos son ácidos.
Los elementos no metálicos forman la mayor parte de la tierra, especialmente las capas más externas, y los organismos están compuestos en su mayor parte por no metales.
Algunos de ellos, en condiciones normales, son diatómicos en el estado elemental:
- Hidrógeno (H2)
- nitrógeno (N2)
- Oxígeno (O2)
- Flúor (F2)
- Cloro (Cl2)
- Bromo (Br2)
- Yodo (I2)
Principales ejemplos
- Hidrógeno
- Carbono
- Nitrógeno
- Fósforo
- Oxígeno
- Azufre
- Flúor
- Cloro
- Bromo
- Yodo
Además de los elementos metálicos y no metálicos, también existen los metaloides, que tienen propiedades intermedias entre ambos grupos.
Ejemplos de metaloides:
- Silicio
- Germanio
- Arsénico








